人类已经发展出四种不同的IgG抗体亚类,它们协调保护人类免受入侵病原体的侵袭。从分子和细胞角度理解这些抗体如何有助于根除病毒感染,可能会指导“超级抗体”的设计,这种抗体可能成为针对新出现的病毒和未来大流行的重要治疗和预防工具,而且还可以用于感染疾病以外的适应症。
抗体是众所周知的抵抗病原体的入侵在细胞外空间,发现实验室的合作者狮子座詹姆斯MRC实验室分子生物学改变了该教条,显示一个关键作用的胞质抗体受体,TRIM21,清除病毒之前有时间复制和传播。通过与奥斯陆大学和奥斯陆大学医院Jan Terje Andersen教授领导的适应性免疫实验室的一系列合作研究,发现了抗体结构和功能之间关系的新知识。
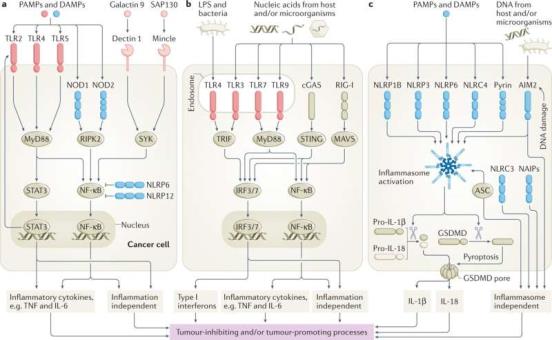
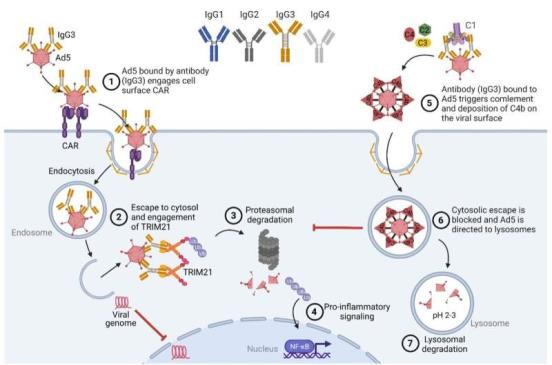
在最近发表于《科学免疫学》(Science Immunology)杂志上的研究中,他们进一步论证了四种人类IgG亚类以不同的方式参与胞质Fc受体TRIM21,随后是结合病毒的靶向降解以及固有信号传导的诱导。重要的是,它们揭示了IgG3比其他三个子类优越,而且这种强大的活性取决于其细长和灵活的铰链区域。此外,他们还表明,补体介导的细胞内抗病毒保护也是如此。
“在任何给定的时间,我们体内只有一小部分IgG3,这与严格的调节和它具有强大的细胞外效应功能有关。因此,这是一个悖论,它是相对不足的研究。在这项研究中,我们提供了一个全面系统的调查,其独特的结构体系结构在病毒感染的背景下。该研究的第一作者、奥斯陆大学药理学研究人员Stian Foss说:“我们证明,在细胞内核内体和胞质空间中,IgG3的长而灵活的铰链区是保护性免疫功能所必需的。”
“人类IgG3与加强对病原体(包括病毒)的控制或保护有关。这项研究很重要,因为它通过剖析IgG3在抗病毒免疫中的结构组成,扩展了我们对IgG3反应的理解。我们展示了这一知识如何应用于工程设计中,改变甚至提高活性超过天然IgG3的IgG抗体,”该研究的高级作者Jan Terje Andersen说。