为了维持细胞内稳态(即平衡状态),细胞进行选择性自噬或不需要的蛋白质的自我降解。自噬受体通过介导靶蛋白的选择来控制这一过程,然后靶蛋白被“清除”。
Tau蛋白在稳定和维持大脑中神经元的内部组织方面发挥着重要作用,在痴呆和阿尔茨海默病等情况下,这种蛋白会在神经元内异常积聚。这种过磷酸化tau蛋白(或tau寡聚物)的积聚会导致痴呆患者大脑中神经元纤维缠结(NFTs)的形成,并最终导致神经元细胞死亡,从而导致痴呆患者神经退行性症状的进展。现在,虽然tau蛋白可以通过选择性自噬降解,但其发生的确切机制仍然是一个谜。
然而,在最近的一项突破中,日本国家量子科学与技术研究所的科学家们所做的一项研究证明了一种特定的基因——p62基因——在tau寡聚体的选择性自噬中发挥了关键作用。研究小组包括研究人员小野舞子(Maiko Ono)和组长Naruhiko撒哈拉(Naruhiko sahara),他们都来自日本国家量子科学与技术研究院的脑功能成像部门。他们的论文发表在《Aging Cell》上,于2022年6月5日在线发布。
既往研究报道tau蛋白的异常积累可能是通过p62受体蛋白(一种选择性自噬受体蛋白)被自噬途径选择性抑制的。Maiko Ono说:“这种蛋白质的泛素结合能力有助于识别有毒的蛋白质聚集物(如tau寡聚物),然后可以被细胞过程和细胞器降解。”
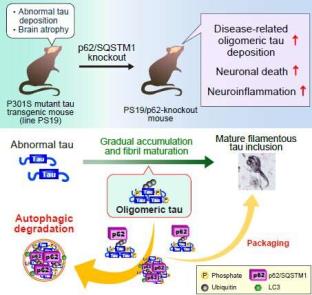
然而,这项研究的新奇之处在于,它展示了p62在一个活的模型上的“神经保护”作用,这是以前从未做过的。那么,研究人员是如何做到这一点的呢?他们使用了痴呆症小鼠模型。在一组小鼠中,p62基因被删除(或敲除),因此它们不表达p62受体蛋白。
在研究这些小鼠的大脑使用免疫染色和比较生化分析,揭示了一个有趣的图片。在p62敲除(KO)小鼠的海马体(大脑中与记忆相关的区域)和脑干(协调身体呼吸、心跳、血压和其他自愿过程的中心)中发现了神经毒性tau蛋白聚集物。当我们考虑到这一点以及痴呆症的症状,包括记忆丧失、思维混乱和情绪变化时,这些发现就很有意义了。
核磁共振扫描显示p62 KO小鼠海马变性(萎缩)、炎症。对他们大脑的尸检评估显示,他们海马体中的神经元损失更大。进一步的免疫荧光研究表明,异常的tau物种聚集可引起细胞毒性,导致p62 KO小鼠的神经元炎症和细胞死亡。具体来说,寡聚tau蛋白在p62 KO小鼠的大脑中积累更多。
总的来说,这项研究的发现证明了p62通过消除并阻止大脑中寡聚tau蛋白的聚集,在痴呆模型中发挥了神经保护作用。
在全世界的研究人员都在努力开发治疗痴呆症和其他相关神经退行性疾病的药物之际,这项研究的发现将为tau寡聚物的准确靶向提供重要的证据。全球老年人口每年都在增加;因此,需要开发方法,以减缓各种神经退行性疾病的发生和发展也在扩大。这项研究为解决这一需求迈出了积极的一步。