治疗阿尔茨海默病的进展缓慢得令人沮丧。休斯顿的一组科学家认为,小规模的挫折可能会导致一种新的治疗方法。
休斯顿大学(UH)和莱斯大学(Rice University)的研究人员与莱斯大学理论生物物理中心(CTBP)合作,通过实验和计算发现,大脑中丰富的淀粉样肽小分子,要经历几个中间阶段的挫折,因为它们“停靠和锁定”在生长的小纤维的尖端。
折叠蛋白倾向于寻找最简单的方式来达到它们的功能形式。类似地,淀粉样β肽寻找最简单的方法与生长中的纤维尖端结合,但有时会受到阻碍——或受挫——因为原子之间的正负力量不能立即对齐。
当它们最终对齐时,生长的原纤维形成了与阿尔茨海默氏症和其他神经系统疾病有关的胶状斑块。发表在《美国国家科学院院刊》(Proceedings of the National Academy of Sciences)上的一项新研究表明,可能会开发出药物,利用多肽受挫的中间状态来稳定原纤维尖端并阻止进一步聚集。
UH化学和生物分子工程师Peter Vekilov说,在他的实验室里研究淀粉样蛋白原纤维的生长并不是一件难事。他说:“以前用原子力显微镜观察纤维蛋白的研究集中在更奇特的行为上,因为淀粉样β纤维具有稳定的生长速度,有点乏味。”
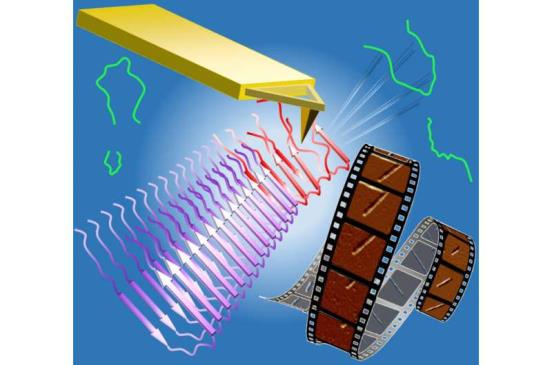
 连续原子力显微镜图像的静止视频显示淀粉样蛋白原纤维被显微镜尖端切割并再生。休斯顿大学和莱斯大学的研究人员发现,淀粉样肽在溶液中经历了几个步骤的挫折,因为它们试图“停靠和锁定”生长的原纤维。资料来源:休斯顿大学Vekilov研究小组
连续原子力显微镜图像的静止视频显示淀粉样蛋白原纤维被显微镜尖端切割并再生。休斯顿大学和莱斯大学的研究人员发现,淀粉样肽在溶液中经历了几个步骤的挫折,因为它们试图“停靠和锁定”生长的原纤维。资料来源:休斯顿大学Vekilov研究小组
Vekilov说:“但我很感兴趣,因为这种增长速度与溶液中多肽浓度的相关性携带了大量的信息。”“它有助于测量速率常数,这个量很容易建模。”
他说,莱斯大学的物理学家彼得·沃林斯(Peter Wolynes)的实验室专门研究蛋白质和染色体折叠的计算机模型,他认为,用尿素破坏蛋白质的稳定生长可能会提供有关淀粉样原纤维形成的有用数据。尿素可以使蛋白质变性(或展开)。它确定了。
“奇怪的事情发生了,”vekilv说。尿素使原纤维变得不稳定,这意味着原纤维中分子之间的键变得不那么牢固。但这也使它们增长得更快。这是一个非常严重的矛盾,违反了化学经验法则。
“但有经验法则,也有基本定律,”他说。“我们认为,这试图告诉我们一些事情。”
Vekilov说,进一步的实验表明,尿素“破坏了错误的肽键的稳定”。“它使原纤维生长得更快,但也向我们展示了中间受挫的步骤。重要的是,我们现在有证据表明,在原纤维的末端有一个挫败的,无序的肽链的冠试图连接和锁定,这些是可药物靶点。
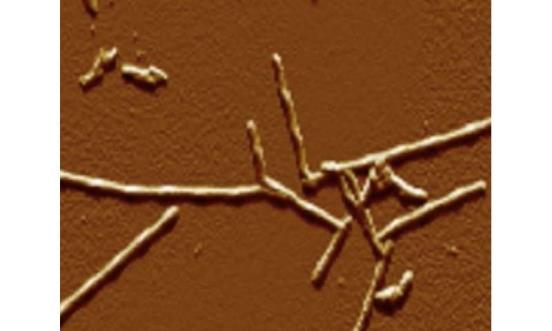
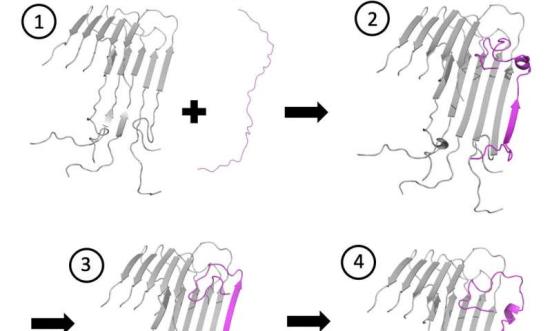 一个由计算得来的序列
莱斯大学制造的nal模型显示淀粉样β肽(洋红色)是如何固定并锁定淀粉样原纤维的。模拟结果揭示了中间co
第二步到第五步的信息,绑定受挫的迹象可能会带来新的治疗机会。来源:凯特琳·纳普/莱斯大学
一个由计算得来的序列
莱斯大学制造的nal模型显示淀粉样β肽(洋红色)是如何固定并锁定淀粉样原纤维的。模拟结果揭示了中间co
第二步到第五步的信息,绑定受挫的迹象可能会带来新的治疗机会。来源:凯特琳·纳普/莱斯大学
他说:“阻止每一个单一的肽是不合理的,因为它们的数量可能是纤维尖端的10万倍。”“我们发现的美妙之处在于,原纤维末端是纤维化的阿喀琉斯之踵,我们所要做的就是阻止末端的复杂结构。”
沃林斯指出,在早期的一项研究中,发现了纤丝聚集中出现阻滞的证据,这表明了挫折的迹象。他说:“实验得出了两个结论。”“一个原因是,几乎所有用于淀粉样蛋白生长的动力学模型都过于简单。这不是意外。另一个是变性改变了平衡,它也可以改变折叠的速度,告诉你转变状态出现在哪里。
“在早期关于原纤维成核的论文中,我们注意到,看起来似乎有一些奇怪的过程,蛋白质不得不从过渡状态后退,”Wolynes说。“所以彼得就去调查这件事,我想他是第一个这样做的人。”
他说,有一种阻止原纤维生长的方法可能有助于解决科学家之间长期存在的分歧,即原纤维是导致神经系统疾病,还是保护大脑免受另一种怀疑,特别是缠结的tau蛋白的影响。
“我们的想法是在顶端下毒,这样它就不能生长,而不是破坏整个原纤维的稳定,”沃林斯补充说。“当然,这引发了关于原纤维是好是坏的大争论。”
计算模型可能表明,抑制原纤维既可以抑制阿尔茨海默病的影响,也可以使其恶化。无论哪种方式,沃林斯说,科学家将有一个更明确的答案。
“在我看来,有趣的是提供了一个新的靶点,我们将探索一些可能改变尖的性质的药物,”他说。“不管怎样,这些分子都将提供有趣的工具来理解原纤维生长是如何发生的。”
哈佛大学的研究生Yuechuan (Alex) Xu和Rice的Kaitlin Knapp是这篇论文的共同作者。共同作者是莱斯博士后研究员Nicholas Schafer和访问教员Aram Davtyan;哈佛大学校友Mohammad Safari,现为普林斯顿大学博士后研究员;凯尔·勒(Kyle Le),哈佛大学校友,莱斯大学前研究实习生。Vekilov是约翰和丽贝卡摩尔斯化学和生物分子工程教授,也是UH的化学教授。沃林斯是布拉德-韦尔奇基金会的科学教授、化学、生物科学、物理和天文学教授,也是CTBP的联合主任。