组织工程血管移植(tevg)通过创建具有生长能力的功能性血管导管,可以促进需要进行先天性心脏手术的婴儿和儿童的外科治疗。在一份新报告发表在医学交流,凯文·g·布卢姆雅各布·c·Zbinden Abhay b Ramachandra和大型团队的多学科和多研究人员使用一个综合computational-experimental方法理解neovessel形成的自然历史的一个大型临床前动物模型。在实验中,他们将大型动物植入研究与体内成像、组织学以及计算生长和重塑方法相结合。这些结果可以为TEVG(组织工程血管移植)重建提供见解,对先天性心脏病儿童的临床转化具有重要意义。
纠正出生缺陷——从实验室到诊所
先天性心脏手术的目的是纠正出生缺陷,需要发展被称为血管移植的人造血管。发展血管导管的潜力,随着患者的发展,拥有巨大的潜力,在推进先天性心脏手术领域。目前,患者通常无法使用合成移植物,需要额外的手术。通过使用组织工程,生物工程师可以形成一个有希望的解决方案,通过创建一个血管导管,与患者一起生长,以缓解体细胞过度生长。该领域正在进行的临床和临床前研究的结果证实了利用tevg形成活体血管导管以探索生物生长潜力的可能性。尽管多个研究小组已经推进了tevg的临床转化,但它们在美国仍有待批准。在这项工作中,研究团队进行了一系列的实验室和计算实验,以了解组织工程血管移植是如何发展成全功能血管的。在实验中,他们发现植入后TEVG存在两个阶段的变化,包括早期炎症和后期机械介导的支架新组织(新组织)重塑。由此产生的血管显示出了生长和对血液流动作出反应的能力,就像人体自身的血管一样。这些结果为TEVG转化为功能性血管的过程提供了见解,具有技术转移到临床实践的含义。
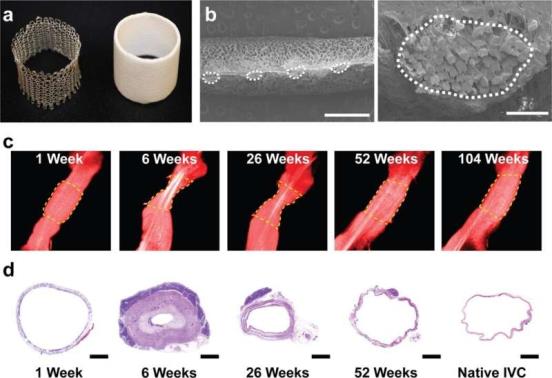
 新组织形成和发展过程中的形态学变化。A) TEVG代表性血管内超声(IVUS)成像,绿色表示管腔,黄色表示TEVG原始大小以供参考。比例尺5mm。B) tevg的重构主要通过两个过程发生,向内重构(蓝色),外径减小,壁内生长(红色),血管壁增厚。C) IVUS测量绵羊模型tevg内径和外径变化的量化。D)高倍代表性三色染色样品通过炎症组织形成和血管新生组织形成来实现壁内生长,随后随着支架降解,壁壁变薄,炎症性新生组织消退,从而产生新血管。比例尺500µm。数据显示为平均值+/-SD。IVUS:血管内超声,TEVG:组织工程血管移植。通信医学doi.org/10.1038/s43856 - 021 - 00063 - 7的computatio最终模型
新组织形成和发展过程中的形态学变化。A) TEVG代表性血管内超声(IVUS)成像,绿色表示管腔,黄色表示TEVG原始大小以供参考。比例尺5mm。B) tevg的重构主要通过两个过程发生,向内重构(蓝色),外径减小,壁内生长(红色),血管壁增厚。C) IVUS测量绵羊模型tevg内径和外径变化的量化。D)高倍代表性三色染色样品通过炎症组织形成和血管新生组织形成来实现壁内生长,随后随着支架降解,壁壁变薄,炎症性新生组织消退,从而产生新血管。比例尺500µm。数据显示为平均值+/-SD。IVUS:血管内超声,TEVG:组织工程血管移植。通信医学doi.org/10.1038/s43856 - 021 - 00063 - 7的computatio最终模型
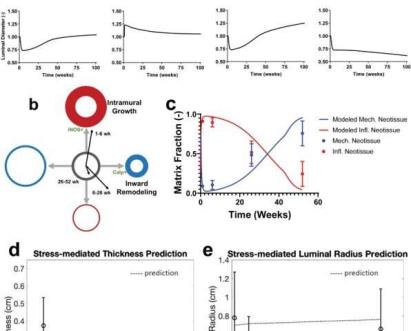
该研究团队在对机械生物学和免疫生物学刺激变化的反应中,建立了超过十年的模拟天然血管生长和重塑的经验的基础上的计算模型。由于TEVG模型是基于一种现有的模型,该模型最初是为了描述和预测天然血管行为而开发的,因此,对支架生物降解模型的修改导致假设,TEVG可以在支架降解时转变为一种模拟天然血管的新血管。在模拟过程中,Blum等人通过几个准平衡步骤跟踪了每一种具有重要结构的壁成分的质量密度,包括聚合物、平滑肌细胞和胶原纤维,并将这些成分的质量密度识别为通过机械生物学过程产生的物质,和免疫生物过程。他们模拟了四个案例研究,并将tevg的行为分为两个阶段,第一个阶段是受支架材料免疫反应影响的新组织形成阶段,第二个阶段是支架降解后发生的新血管重塑。该模型的一个关键结果强调了新血管的生长和重塑是如何模拟天然血管中纯机械介导的动力学的。
描述neovessel形成
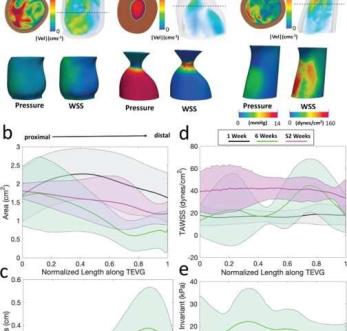 新血管形成过程中的血流动力学变化。A) tevg植入后1周、6周和52周的tevg三维解剖模型,具有代表性的速度幅度(峰值流量)、压力和壁切应力图(在心动周期平均),由FSI模拟测量。一个correspo
末截面显示通过TEVG体积的切片(虚线)及其对应的流动
扩散连接腔的厚度。注意时间点上速度幅度的增加,直径和长度从1周到6周的减少,以及几何变化的结果流型。平均±标准偏差管腔横切面
在每个时间点沿移植物归一化长度显示的nal面积(B)、血管壁厚度(C)、时间平均壁剪切应力(D)和Cauchy应力(在心脏周期上平均)(E)。近端到远端箭头指示流动方向。TEVG:组织工程血管移植,FSI:流固相互作用。通信医学doi.org/10.1038/s43856 - 021 - 00063 - 7
新血管形成过程中的血流动力学变化。A) tevg植入后1周、6周和52周的tevg三维解剖模型,具有代表性的速度幅度(峰值流量)、压力和壁切应力图(在心动周期平均),由FSI模拟测量。一个correspo
末截面显示通过TEVG体积的切片(虚线)及其对应的流动
扩散连接腔的厚度。注意时间点上速度幅度的增加,直径和长度从1周到6周的减少,以及几何变化的结果流型。平均±标准偏差管腔横切面
在每个时间点沿移植物归一化长度显示的nal面积(B)、血管壁厚度(C)、时间平均壁剪切应力(D)和Cauchy应力(在心脏周期上平均)(E)。近端到远端箭头指示流动方向。TEVG:组织工程血管移植,FSI:流固相互作用。通信医学doi.org/10.1038/s43856 - 021 - 00063 - 7
科学家们开发了这种支架,将聚乙醇酸(PGA)纤维编织成管状,并涂上50:50的聚己内酯和聚l -丙交酯共聚物,形成多孔海绵。所设计的支架可以通过水解溶解。在植入绵羊模型后,该团队注意到在最初的26周内支架的形态发生了变化,随后52周支架完全降解,形成了一根新血管,其外观类似于天然血管。基于植入后52周的一系列血管内超声成像,该团队观察到了关于演化tevg形态的额外信息,以及在特定时间段内对外植体的组织学评估。接下来,该团队在体外和体内进行了新血管生长和重塑过程中的生物降解研究,以检查材料的质量递减,这种材料最初提供了应力屏蔽和炎症刺激。他们分别注意到了在高达70摄氏度的磷酸盐缓冲溶液中生物降解的速度以及在体外和体内生物降解的动态时间框架。实验室研究表明,在聚合物降解过程中支架的依从性逐渐增强。科学家们还通过观察炎症标记物的存在来检测支架诱导的体内炎症,并将TEVG的生物力学特性归因于材料行为和新组织成分。
 Computatio
该模型预测TEVG新血管形成。一)Computatio
TEVG新组织形成演示的G&R模型
证明炎症和机械力介导的新组织形成和重建的联合作用,预测了实验测试的移植物(左)。Additio
最终computatio
没有免疫反应的理论案例的Nal模型结果
Nse(左中),o
只有免疫反应
Nse(右中),以及新组织产生缺乏机械调节(右中)。B)内重塑与壁内生长图,随时间变化的演示
从原点用箭头表示。C)计算的比较
炎症性和机械性新组织对组织学结果的建模预测。D)应力介导的厚度预测,E)应力介导的腔区面积预测
对血液动力学和形态学测量进行了计算
血流动力学的研究和流动和压力的扰动是成比例的假设
它们的体内平衡值。用此比例计算的微动剪应力和周向应力
代表公司
推测瞬变和由此产生的厚度和半径变化。取52周的本地IVC值作为体内平衡值。测量值+/-标准偏差通过圆形标记显示。所有数值均以近端至远端吻合口距离的77%计算,其中
狭窄通常发生在6周大的绵羊身上。TEVG:组织工程血管移植,G&R:生长和重塑,IVC:下腔静脉。通信医学doi.org/10.1038/s43856 - 021 - 00063 - 7
Computatio
该模型预测TEVG新血管形成。一)Computatio
TEVG新组织形成演示的G&R模型
证明炎症和机械力介导的新组织形成和重建的联合作用,预测了实验测试的移植物(左)。Additio
最终computatio
没有免疫反应的理论案例的Nal模型结果
Nse(左中),o
只有免疫反应
Nse(右中),以及新组织产生缺乏机械调节(右中)。B)内重塑与壁内生长图,随时间变化的演示
从原点用箭头表示。C)计算的比较
炎症性和机械性新组织对组织学结果的建模预测。D)应力介导的厚度预测,E)应力介导的腔区面积预测
对血液动力学和形态学测量进行了计算
血流动力学的研究和流动和压力的扰动是成比例的假设
它们的体内平衡值。用此比例计算的微动剪应力和周向应力
代表公司
推测瞬变和由此产生的厚度和半径变化。取52周的本地IVC值作为体内平衡值。测量值+/-标准偏差通过圆形标记显示。所有数值均以近端至远端吻合口距离的77%计算,其中
狭窄通常发生在6周大的绵羊身上。TEVG:组织工程血管移植,G&R:生长和重塑,IVC:下腔静脉。通信医学doi.org/10.1038/s43856 - 021 - 00063 - 7
血流动力学和新组织分析
然后Blum等人通过对受试者进行特定的计算模拟和计算主要血流动力学指标的3D地图来建立植入后tevg的3D解剖模型,评估进化的新血管支架及其形态变化对血流动力学的影响。模拟突出了支架在体内的自然发展历程,狭窄的发展由管腔横截面积的显著狭窄证明,52周后逆转。进一步的分析表明,在支架进化过程中,免疫和机械介导的新组织形成的范围和时间的重要性。根据模拟结果,Blum等人认为支架降解后的生长和重塑会逐渐生成一种模仿天然血管的新血管。植入52周后,他们使用表面扫描电子显微镜观察到内皮细胞持续覆盖腔内,并使用免疫荧光染色观察到内皮细胞融合。在生化刺激下,新血管也表现出与天然血管相似的收缩反应,提示具有生物启发功能的天然仿生结构。
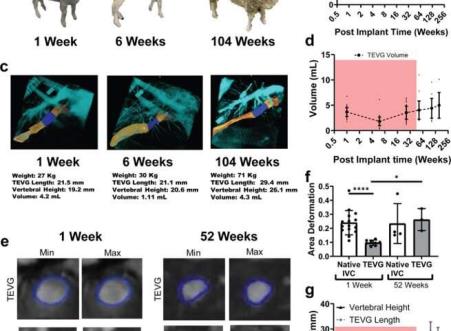
 TEVG neovessels演示nstrate生物的生长。A)绵羊着床后代表性生长图像。B) tevg植入物和非植入物的重量量化控制动物长期植入。C)绵羊植入期间代表性的3D血管造影图像。原生下腔静脉呈黄色,TEVG呈深蓝色,周围解剖结构呈浅蓝色。测量结果取自如下所示的每个代表性图像。D) TEVG体积随时间的量化。E) 1周(左)和52周(右)时,MRI测量的移植物中TEVG在一个心动周期内最小和最大面积的代表性图像。F) TEVG和邻近IVC在植入后1周和52周的面积变形量化。G)血管造影测量的TEVG和椎体长度。红框表示TEVG完全降解的时间。数据显示为平均值+/-SD。采用不等方差Mann-Whitney检验确定区域变形数据的统计显著性。*<0.05, **<0.01, ***<0.001, ****<0.0001。TEVG:组织工程血管移植,IVC:下腔静脉,MRI:磁共振结果娘娘腔的成像。通信医学doi.org/10.1038/s43856 - 021 - 00063 - 7从实验室到临床儿科人群的展望
TEVG neovessels演示nstrate生物的生长。A)绵羊着床后代表性生长图像。B) tevg植入物和非植入物的重量量化控制动物长期植入。C)绵羊植入期间代表性的3D血管造影图像。原生下腔静脉呈黄色,TEVG呈深蓝色,周围解剖结构呈浅蓝色。测量结果取自如下所示的每个代表性图像。D) TEVG体积随时间的量化。E) 1周(左)和52周(右)时,MRI测量的移植物中TEVG在一个心动周期内最小和最大面积的代表性图像。F) TEVG和邻近IVC在植入后1周和52周的面积变形量化。G)血管造影测量的TEVG和椎体长度。红框表示TEVG完全降解的时间。数据显示为平均值+/-SD。采用不等方差Mann-Whitney检验确定区域变形数据的统计显著性。*<0.05, **<0.01, ***<0.001, ****<0.0001。TEVG:组织工程血管移植,IVC:下腔静脉,MRI:磁共振结果娘娘腔的成像。通信医学doi.org/10.1038/s43856 - 021 - 00063 - 7从实验室到临床儿科人群的展望
neovessels科学家进一步研究生物发展基于渐进变化的大小、形状和功能在开发和成熟的有机体通过少年(四个月)羊羔表明,随着羊羔羊成熟,年龄结构限制的动物没有任何增长。他们也揭示了该方法相对于计算建模过程的局限性。通过这种方法,Kevin G. Blum和同事们全面研究了TEVG(组织工程血管移植)向新血管的转化,在移植的前6个月,新血管最终表现得像原生血管一样,生长/重塑不良。在这一关键时期之后,新血管进化出具有生物生长潜力,包括具有生物激发血流动力学功能的完整内皮细胞,以及具有高度顺应性和血管活性的血管壁,以匹配其植入的血管。结果对儿科人口有显著影响。该团队设想继续优化计算-实验方法,以提高从实验室到临床的技术转移的时间和成本效益。